Entre las manifestaciones clínicas que pueden aparecer en los pacientes infectados por el VIH, la afectación hepática constituye en la actualidad una de las más frecuentes, siendo uno de los principales motivos de hospitalización y de morbimortalidad en los pacientes infectados por el VIH.
Si bien otros muchos procesos pueden afectar al hígado en los sujetos VIH+, las hepatitis víricas, especialmente las producidas por los virus B (VHB), C (VHC) y Delta (VHD), son las más frecuentes, debido a que estos virus comparten los mismos mecanismos de transmisión del VIH. Además, la enfermedad hepática por los virus hepatotropos se comporta de forma más agresiva en los pacientes coinfectados por el VIH. La generalización de las terapias antirretrovirales de gran potencia (TARGA, highly active antiretroviral therapy) ha comportado una drástica reducción en la mortalidad y morbilidad asociadas a la infección por el VIH.
Esta mejora en la supervivencia ha permitido, sin embargo, que afloren otros procesos que hasta ahora apenas tenían relevancia. Las hepatitis crónicas víricas son enfermedades de evolución mucho más lenta que la infección por VIH. Así, mientras que un 80% de los pacientes infectados por VIH fallecían antes de los 15 años si no recibían medicación, la mortalidad de la hepatitis C es inferior al 15% a los 30 años. La mejoría espectacular en el pronóstico de la infección por VIH tras la introducción del TARGA, junto con la evolución más rápida a cirrosis en los pacientes coinfectados por VIH y VHC, explican que actualmente hasta una cuarta parte de los ingresos hospitalarios en los sujetos VIH+ estén relacionados con su hepatopatía .
Como la infección por VHC se cronifica en los adultos más que la producida por el virus B (85% versus 10%), el hallazgo más frecuente es el de pacientes coinfectados por VIH-VHC .Los efectos secundarios y la toxicidad de los fármacos antirretrovirales constituyen una de las principales limitaciones del TARGA. Una de las complicaciones más frecuentes es la hepatotoxicidad, siendo mayor su incidencia en los pacientes con hepatopatía crónica vírica subyacente. Por otra parte, el trastorno hepático obliga a suspender el tratamiento anti-VIH. De este modo, la hepatitis crónica constituye un factor limitante de las expectativas del paciente. El tratamiento de la enfermedad hepática, con la posible erradicación del virus hepatotropo, puede mejorar el pronóstico de estos pacientes.
El manejo terapéutico de la hepatitis crónicas víricas B, C y/o D en los pacientes coinfectados por el VIH reviste unas características especiales.
El deterioro inmunológico, consecuencia de la infección por VIH, influye sobre la tasa de respuesta al interferón, de modo que es preferible tratar la hepatitis C en los sujetos sin inmunodeficiencia avanzada.
HEPATITIS B Y DELTA EN SUJETOS VIH +
Entre el 70% y el 90% de los pacientes infectados por el VIH tienen marcadores serológicos de infección – actual o pasada – por el VHB. En los adultos inmunocompetentes, la infección se cronifica en un 5-10% de los casos. En los individuos coinfectados por VIH, este porcentaje es mayor, de modo semejante a lo que ocurre en los neonatos y en niños menores de 5 años.
La lesión hepática consecuencia de la infección por el virus B es secundaria a la respuesta inmune del huésped, sumada al efecto citopático –probablemente menos importante– del propio virus. La existencia del daño citopático directo se pone de manifiesto en los casos de recidiva de la infección por VHB en pacientes transplantados, que están inmunodeprimidos farmacológicamente.
En ellos puede observarse una hepatitis colestásica fibrosante, asociada a títulos muy elevados de replicación del VHB. En el caso de los pacientes coinfectados por VIH, este daño directo se pone de manifiesto por una mayor frecuencia de cirrosis. Esto sugiere que en condiciones de inmunosupresión, la progresión de la fibrosis pueden tener lugar a un con un mínimo componente inflamatorio. La infección por VIH puede actuar como un factor "enmascarador" de la lesión hepática por VHB: una menor inflamación, con mínima o nula elevación de transaminasas, ocultaría una fibrosis hepática acelerada.
La mayor replicación del VHB en los pacientes VIH+ parece depender de una menor actividad de los linfocitos T citotóxicos CD8+, secundaria a un compromiso del número y función de los linfocitos T CD4+ y de los monocitos. Esto explicaría que en los individuos con enfermedad más avanzada por VIH (pacientes con Sida), el grado de replicación del VHB sea mayor que en los pacientes VIH+ asintomáticos. Además, la infección por VIH se asocia con menor producción de interferón alfa, lo que puede facilitar la persistencia del VHB y reducir la agresión del sistema inmune sobre el hepatocito infectado.
Los pacientes VIH+ con hepatitis crónica B suelen tener un mayor valor de fosfatasa alcalina. Esto puede estar relacionado con un cierto grado de colangitis inducido por el propio VIH, o ser efecto directo del VHB.
A medida que pasa el tiempo desde el momento de la infección aguda por el VHB, hay una reducción espontánea de la replicación viral, como se demuestra mediante la cuantificación del ADN-VHB en suero. Sin embargo, en los pacientes VIH+ esta reducción es menor. En ocasiones, esta disminución se acompaña de una pérdida espontánea del HBeAg, no necesariamente acompañada del desarrollo de Anti-HBe. La tasa de pérdida del HBeAg es también menor en los pacientes VIH+ (49% versus 12%).
Se han descrito dos situaciones peculiares en los pacientes coinfectados por VHB y VIH. En primer lugar, se ha observado una reactivación espontánea de la replicación del VHB, con reaparición del HBeAg, especialmente en los pacientes más inmunodeprimidos. En ocasiones esta reactivación se debe a la retirada o al desarrollo de resistencias a la lamivudina, administrada frente al VIH, pero que también es activa frente al VHB. La segunda situación corresponde a una reaparición del HBsAg en suero, generalmente con HBeAg, en sujetos que tenían marcadores serológicos de infección pasada por VHB (anti-HBs y anti-HBc). Esta circunstancia se ha observado ocasionalmente en sujetos muy inmunodeprimidos, y muestra cierta similitud con descripciones previas en sujetos con procesos hematológicos bajo quimioterapia. Estas reactivaciones muestran que la presencia de marcadores de inmunidad no significa una erradicación completa del VHB.
Respecto a la hepatitis delta, existe una peculiaridad en los pacientes VIH+. En la mayoría de los pacientes VIH negativos con hepatitis D, la replicación del virus B está suprimida, con presencia de HBsAg, pero ausencia de HBeAg y ADN-VHB en suero. Sin embargo, en los pacientes VIH+ el trastorno inmunitario parece que permite un escape viral B y delta, que explica una pérdida de la inhibición de la replicación del VHB cuando está presente el VHD. Hay positividad para HBeAg y ADN-VHB generalmente. Más aún, en estos pacientes la hepatitis crónica D cursa a menudo con antígeno delta detectable en suero, lo cual es excepcional en los pacientes inmunocompetentes.
El mecanismo de daño hepático producido por el VHD parece ser citopático directo. Al ser la replicación delta mayor en los pacientes VIH+, la enfermedad hepática es más grave, con progresión rápida a cirrosis. El síndrome de reconstitución inmune consecuencia de la supresión brusca de la replicación del VIH tras iniciar terapia antirretroviral potente, puede propiciar una respuesta inflamatoria aguda frente a los hepatocitos que expresan antígenos del VHB.
Puede haber una elevación brusca de las transaminasas, que puede confundirse con una reacción de hepatotoxicidad de la medicación . Si el cuadro no es muy grave y no se suspende el tratamiento antirretroviral, la hepatitis remite espontáneamente. Algunos autores han sugerido que la utilización de antiinflamatorios podría ser beneficiosa en estos casos. Por otro lado, la administración de fármacos como el 3TC, con actividad tanto frente al VIH como el VHB, podría paliar este efecto indeseado en los pacientes coinfectados.
TRATAMIENTO
La indicación del tratamiento de la hepatitis B en los pacientes coinfectados por VIH es controvertida. Claramente, el VHB produce un daño importante en estos pacientes. Además, el empeoramiento clínico observado como consecuencia de la reconstitución inmune tras iniciar la medicación antirretroviral puede resultar un factor limitante de importancia. Al igual que en los sujetos VIH negativos, el objetivo del tratamiento de la hepatitis crónica B en los pacientes coinfectados es la desaparición del HBeAg, o la pérdida del ADN-VHB en suero, lo que significa el paso a la fase "no replicativa"de la enfermedad.
Por tanto, el tratamiento sólo puede plantearse en los sujetos HBsAg positivos en fase replicativa, esto es, con HBeAg y/o ADN-VHB en suero y que, además, tengan actividad inflamatoria hepática (hipertransaminasemia).
El tratamiento estándar frente a la infección por VHB es el interferón alfa (IFN). Estudios iniciales mostraron que la eficacia en los pacientes VIH+ era menor que en los sujetos VIH negativos. Además, la toxicidad no es despreciable.
La lamivudina (3TC), utilizada frente al VIH desde hace tiempo, muestra también actividad frente al VHB. Aunque no es un fármaco erradicador, inhibe la ADN-polimerasa-ARN-dependiente del VHB, consiguiendo la negativización del ADN-VHB sérico en un 75% de los casos y la seroconversión frente al HBeAg en un 25% de ocasiones. Algunos han defendido una terapia de mantenimiento con este fármaco, que es de administración oral y bien tolerado. En cualquier caso, en los pacientes coinfectados es recomendable incluir el 3TC entre los componentes del régimen antirretroviral elegido.
EPIDEMIOLOGÃA DE LA HEPATITIS C EN LA POBLACIÓN VIH +
El VHC es el agente principal de enfermedad hepática crónica en los pacientes infectados por VIH. La prevalencia global de la infección por VHC en los pacientes VIH+ es del 33% en la cohorte del EuroSida, que incluye más de 4000 pacientes VIH+ europeos , con variaciones dependiendo de los distintos colectivos de riesgo, siendo el más afectado el de los adictos a drogas por vía parenteral (ADVP), en el que la prevalencia es del 75%. Se estima que la exposición al VHC tiene lugar durante el primer año de adicción con intercambio de jeringuillas en más del 75% de ocasiones y que el efecto acumulativo en los años siguientes es mínimo, aunque permite la reinfección por diferentes subtipos del VHC. En algunas series de hemofílicos, la prevalencia de infección por VHC es próxima al 100%.
ANALOGÃAS VHC-VIH
Ambos virus comparten diversas características, además del mecanismo de transmisión. Son virus ARN, el VIH de la familia Retroviridae, con dos cadenas de ARN monocatenario, y el VHC de la Flaviviridae, únicamente con una cadena. El proceso de replicación viral, en cambio, es muy diferente.
Mientras que el VIH presenta una fase de integración en el genoma de la célula huésped, la replicación del VHC se realiza en el citoplasma de la célula hepática. Por no existir integración en el genoma huésped en el caso del VHC, la posibilidad de erradicar la infección es más factible, a diferencia de lo que ocurre en la infección por VIH o en la hepatitis B.
Por tratarse de virus ARN, el VIH y el VHC comparten una elevada tasa de error en la replicación viral. Como resultado, las secuencias genómicas de los viriones muestran una elevada variabilidad. De hecho, los virus encontrados en un mismo paciente infectado muestran diferencias en sus secuencias. El término de cuasiespecies se aplica al conjunto de secuencias de los viriones en un sujeto dado. A nivel global, la semejanza de distintas secuencias del VHC permite agruparlas en subtipos. Hasta ahora se han descrito al menos 30 subtipos del VHC. La elevada variabilidad genética constituye un mecanismo excelente de adaptación biológica, que permite al virus desarrollar rápidamente mecanismos de evasión frente a la presión del sistema inmune o la medicación antiviral. Las regiones más variables, tanto del VIH como del VHC, son las que codifican la envuelta viral, que es la región más expuesta y, por tanto, más inmunogénica.
La clasificación de las diferentes variantes del VHC y del VIH tiene trascendencia clínica. Los distintos subtipos pueden presentar una diferente distribución geográfica o una distinta susceptibilidad frente a la medicación antiviral. Así, el subtipo 3a del VHC es el más común entre los ADVP europeos, mientras que el subtipo 1b suele ser poco sensible al tratamiento con IFN.
HISTORIA NATURAL DE LA HEPATITIS C EN LOS PACIENTES VIH +
La hepatopatía producida por el VHC es más grave en los pacientes coinfectados por VIH. En un estudio español, el 6,5% de los pacientes VIH negativos con hepatitis crónica C presentaron cirrosis 15 años después de la exposición al VHC, mientras que ésta ocurrió en un 25% de los sujetos VIH+. Esto ha sido confirmado en un estudio francés reciente. Los pacientes VIH+ presentan tanto un mayor grado de fibrosis como una mayor actividad necroinflamatoria. El tiempo medio entre la fecha de exposición al VHC y el desarrollo de cirrosis fue de 26 años en los pacientes VIH+ frente a 34 años en los VIH negativos.
El mismo estudio señaló que los pacientes coinfectados que recibieron TARGA mostraron una evolución aparentemente más lenta de su enfermedad hepática. Por otro lado, los sujetos con un número menor de linfocitos CD4+ (< 200 células/mm3) presentaron una evolución más rápida a cirrosis. Recientemente se han descrito varios casos de hepatocarcinoma en sujetos coinfectados, casi todos ellos de evolución fatal a corto plazo y de aparición a edades más tempranas que en sujetos VIH negativos.
La evolución más rápida de la hepatopatía C en los pacientes VIH+ se relaciona con el trastorno inmune. Los linfocitos T citotóxicos (CTL) controlan la infección por VHC eliminando los hepatocitos infectados. Colaboran en esta acción algunas citoquinas producidas por las células T CD4+, algunas de las cuales activan la respuesta CTL (CD8+) mientras que otras inhiben directamente la replicación viral. En la infección por VIH, el número y función de los linfocitos CD4+ está comprometido, lo cual comporta una deficiente respuesta frente al VHC.
Los sujetos coinfectados presentan una viremia C mayor que los VIH negativos y, a la vez, una progresión más rápida a cirrosis. Ambos fenómenos, sin embargo, no están directamente relacionados, puesto que, a diferencia de lo que ocurre en la infección por VIH, la viremia C no predice la velocidad de progresión a cirrosis. De todos modos, una mayor viremia C comporta una menor probabilidad de respuesta al tratamiento antiviral.
Varios estudios han examinado el papel de la recuperación inmune secundaria al tratamiento antirretroviral sobre la viremia C. En 16 pacientes coinfectados de nuestro centro, que presentaron buena respuesta a TARGA, la carga viral C cayó más de 1 log de promedio al cabo de un año. Sin embargo, antes de ese momento no se apreció un beneficio virológico significativo y al tercer mes incluso los niveles de viremia C estaban más elevados que en el momento basal, probablemente como reflejo de una mayor destrucción de hepatocitos infectados al recuperarse la respuesta inmune.
HEPATOTOXICIDAD DE LOS ANTIRRETROVIRALES
La disponibilidad de nuevos fármacos con una importante actividad inhibitoria de la replicación del VIH ha transformado por completo el pronóstico de los pacientes VIH+. Sin embargo, la toxicidad hepática de los antirretrovirales constituye una de sus principales limitaciones y, a menudo, supone la causa de su retirada. Un estudio realizado en nuestro centro demostró que un 14% de los pacientes que iniciaron TARGA con al menos un inhibidor de la proteasa desarrollaron hepatotoxicidad franca. Esta complicación fue más frecuente en los ADVP, en relación con la mayor prevalencia de hepatitis crónica C en este colectivo. Otros estudios más recientes han confirmado esos hallazgos, lo cual subraya la conveniencia de tratar a tiempo la hepatitis crónica C en los pacientes VIH+, ya que puede condicionar una mejor tolerancia de la terapia antirretroviral.
Los mecanismos por los que puede aparecer daño hepático en los pacientes coinfectados por VIH y VHC que reciben medicación antirretroviral están fundamentalmente relacionados con el daño citopático directamente producido por el fármaco, el síndrome de reconstitución inmune y las reacciones de hipersensibilidad.
Tratamiento de la hepatitis crónica C en pacientes con infección por VIH
El interés por la hepatitis C en los pacientes VIH+ se ha puesto de manifiesto en las dos últimas conferencias de consenso sobre el tratamiento de la hepatitis C, celebradas en Estados Unidos y en Europa. En ambas se ha recomendado el tratamiento en los sujetos VIH+ con una buena situación inmune.
La valoración de la respuesta al tratamiento no debe ser bioquímica (basada en el nivel de transaminasas), sino virológica. Una respuesta completa es aquélla que consigue la desaparición del ARN-VHC en el suero al final del tratamiento. La respuesta sostenida se define por la persistencia de viremia C negativa 6 meses tras finalizar el tratamiento. El objetivo de la terapia anti-VHC debe perseguir la respuesta sostenida.
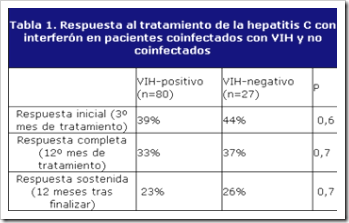
El interferón-alfa (IFN) ha sido el único tratamiento disponible frente a la hepatitis C durante muchos años. En sujetos VIH negativos, la tasa de respuesta sostenida con IFN era baja, inferior al 20%. Una respuesta similar se observa en los pacientes VIH+ sin una inmunodeficiencia severa.
(Tabla 1). En los sujetos VIH+ más inmunodeprimidos, la respuesta terapéutica se reduce significativamente. Los pacientes coinfectados que alcanzan una respuesta sostenida con el tratamiento no tienen un mayor riesgo de recidiva que los sujetos VIH negativos, a pesar de progresar la inmunodeficiencia.
Esto sugiere que la erradicación del VHC con el tratamiento específico es un objetivo realmente alcanzable.
Tabla 1. Respuesta al tratamiento de la hepatitis C con interferón en pacientes coinfectados con VIH y no coinfectados
La combinación de IFN y Ribavirina (RBV), un antiviral con acción frente a virus ADN y ARN, ha permitido alcanzar tasas de respuesta sostenida cercanas al 50% en sujetos VIH negativos, lo que supone más del doble del beneficio proporcionado con la monoterapia con IFN. Actualmente, la terapia combinada es la modalidad recomendada. Además, la adición de RBV no ha supuesto un aumento significativo de los efectos adversos.
Únicamente la aparición de anemia hemolítica, habitualmente dosis-dependiente, parece más frecuente en los pacientes tratados con RBV. Varios ensayos actualmente en curso persiguen demostrar si dosis inferiores de RBV (p.e., 600-800 mg/día) permiten obtener la misma actividad antiviral, con una menor frecuencia de anemia hemolítica. La eficacia de la combinación IFN+RBV en sujetos VIH+ no es todavía bien conocida. Un estudio piloto realizado en nuestro centro, que incluía 18 pacientes previamente tratados con IFN, todos ellos con más de 300 linfocitos CD4+/mL, demostró que la tasa de respuesta sostenida fue del 35%, aunque un tercio de los pacientes no completaron los 6 meses de tratamiento por diferentes razones. Otro estudio francés, que incluyó 20 pacientes coinfectados, observó una tasa de respuesta completa al final del tratamiento del 50%. Sin embargo, la heterogeneidad en las características de los pacientes de ese estudio no permite generalizar los resultados. Un 45% de los pacientes eran cirróticos, y un 20% habían sido pretratados con IFN.
Se han ensayado diversas estrategias para incrementar la tasa de respuesta en la hepatitis C. La utilización de regímenes de inducción, con una mayor dosis de IFN en las primeras semanas –habitualmente al menos un mes- seguido de la dosis estándar hasta completar un año, ha demostrado ser más eficaz en algunos estudios. Esta estrategia se basa en la corta vida media del ciclo de replicación del VHC, inferior a 3 horas. La administración del IFN sólo 3 veces por semana permitiría lapsos prolongados de ausencia del medicamento en la circulación, que permitirían un cierto escape viral y la selección de virus resistentes. La administración más frecuente del IFN podría ayudar a paliar este inconveniente.
Otra alternativa la constituyen las nuevas formulaciones del IFN. La unión covalente de polietilenglicol (PEG) transforma al IFN en una molécula más hidrosoluble y de más larga vida media (IFN pegilado, PEG-IFN). La mayor persistencia del fármaco en el organismo permite una dosificación semanal, lo que por otro lado facilita un buen cumplimiento. Actualmente están disponibles dos formas de PEG-IFN, que varían según el tamaño de la molécula y el tipo de IFN utilizado. Resultados preliminares sugieren que las tasas de respuesta sostenida, sin RBV, son mayores que las que se consiguen con IFN sólo. Probablemente la adición de RBV mejore aún más esos resultados. Por el momento, no existen resultados en pacientes coinfectados con VIH. Los efectos secundarios del PEG-IFN son similares a los que aparecen con IFN, aunque la neutropenia es más frecuente y más pronunciada.
Recientemente se han comunicado resultados de la terapia triplecon PEG-IFN, RBV y Maxamina. La actividad antiviral de esta combinación parece ser mayor. La identificación de nuevos fármacos con actividad anti-VHC sin duda permitirá mejorar las tasas de respuesta actuales.
Indicaciones del tratamiento de la hepatitis crónica C en sujetos coinfectados por VIH
Los criterios comúnmente aceptados para indicar el tratamiento de la hepatitis crónica C son:
i) incremento persistente de las transaminasas,
ii) ARN-VHC positivo en suero y
iii) presencia de actividad necroinflamatoria y fibrótica en la biopsia hepática.
La decisión de tratamiento en los pacientes coinfectados con VIH debe sumar, además, otros parámetros, como es un estado inmunológico preservado. Como en los pacientes VIH negativos, no deben tratarse los pacientes cirróticos clínicamente descompensados, ni tampoco los que tienen transaminasas normales. Desde el punto de vista del VIH, debe requerirse un control máximo de la replicación viral con la medicación antirretroviral, antes de indicar la terapia anti-VHC.
Si la carga viral VIH es indetectable y la cifra de linfocitos CD4+ es superior a 200-300 células/mL, es adecuado considerar el tratamiento frente a la hepatitis C. En sujetos VIH+ la respuesta a la terapia anti-VHC es ligeramente inferior a la observada en pacientes inmunocompetentes cuando la cifra de linfocitos CD4+ es menor de 500 células/mL.
En estos casos, la decisión de tratar la hepatitis debería basarse en el riesgo de progresión de la enfermedad hepática (basado en criterios histológicos, función hepática, duración estimada de la infección, etc.), y las características del paciente (posibilidades de buen cumplimiento terapéutico, tolerancia esperada del régimen propuesto, interacciones con otros fármacos, etc.), los cuales pueden influenciar en gran medida las posibilidades de respuesta al tratamiento.
Los pacientes VIH+ con inmunodeficiencia severa –menos de 200 células CD4+/mL– no deberían ser tratados, a la vista de las escasas posibilidades de respuesta al tratamiento y al elevado riesgo de desarrollar eventos diagnósticos de Sida. Además, la administración de IFN produce en ocasiones un descenso de la cifra de linfocitos CD4+, generalmente autolimitada, que en los pacientes VIH+ puede ser particularmente desafortunada.
Interacciones y efectos adversos de la terapia anti-VHC en sujetos VIH+
La administración de dosis estándar de IFN para el tratamiento de la hepatitis crónica C (3-5 megaU tres veces por semana) puede dar lugar –como se ha comentado previamente– a un rápido descenso de la cifra de linfocitos CD4+. Ocurre en alrededor del 10% de los pacientes VIH+. Aparece generalmente entre las semanas 6 y 14 del tratamiento y, generalmente, es autolimitada. En la mayoría de ocasiones, este descenso refleja un desplazamiento de las células CD4+ desde el compartimiento vascular a los tejidos, más que una destrucción real de linfocitos CD4+. De hecho, no hay una elevación de la replicación del VIH durante estos períodos de linfopenia inducida por IFN.
Con respecto a la RBV, hay pocos datos in vivo sobre las posibles interacciones con los fármacos antirretrovirales. Estudios in vitro han demostrado que la RBV inhibe la fosforilación de algunos análogos de nucleósidos, como AZT y d4T, ambos sustratos de la timidín-kinasa. No se conoce exactamente el impacto in vivo de este fenómeno. Finalmente, la anemia hemolítica por RBV, que constituye el efecto adverso más común de este fármaco, previene frente al uso concomitante de otros fármacos mielosupresores como la zidovudina.
RESUMEN
- La supervivencia de los individuos infectados por VIH se ha alargado considerablemente tras la introducción de las terapias antirretrovirales de alta potencia (TARGA).
- Aunque la incidencia de las clásicas infecciones oportunistas se ha reducido drásticamente, otros procesos han adquirido relevancia, como la enfermedad hepática producida por los virus de las hepatitis B, C y/o D.
- La historia natural de las hepatitis crónicas víricas se acelera en los pacientes con inmunodeficiencia por VIH. De este modo, en países como España donde una elevada proporción de sujetos VIH+ están coinfectados por el virus de la hepatitis C (VHC), actualmente más de una cuarta parte de los ingresos hospitalarios de los pacientes VIH+ están ocasionados por descompensaciones de una hepatopatía crónica. A menudo estos episodios están precipitados por la hepatotoxicidad de algunos antirretrovirales.
- El tratamiento de la hepatitis crónica C constituye una prioridad en el manejo de los pacientes coinfectados por VIH y VHC. La información disponible sugiere que la tasa de respuesta al tratamiento con interferón (IFN) es similar al obtenido en la población VIH negativa, siempre y cuando la inmunidad esté preservada. De igual modo, datos preliminares sugieren que la terapia combinada con IFN y ribavirina permite obtener la curación en alrededor de un 40-50% de los pacientes. La administración de IFN pegilado (más ribavirina) probablemente supondrá un beneficio adicional en estos pacientes.
R Rodríguez-Rosado,M Pérez-Olmeda,J García-Samaniego,V Soriano.
BIBLIOGRAFÃA
Benhamou Y, Bochet M, Di Martino V et al. Liver fibrosis progression in HIV and Hepatitis C Virus coinfected patients. Hepatology 1999; 30: 1054-8.
Carr A, Cooper D. Restoration of immunity to chronic hepatitis B infection in HIV-infected patient on protease inhibitor. Lancet 1997; 349:995-6.
Colin J, Cazals-Hatem D, Loriot M et al. Influence of HIV infection on chronic hepatitis B in homosexual men. Hepatology 1999; 29: 1306-10.
Chisari F, Ferrari C. Hepatitis B immunopathogenesis. Annu Rev Immunol 1995; 13: 29-60.
De Pouplana M, Soriano V, García-Samaniego J, et al. More severe course of delta hepatitis in HIV-infected patients. Genitourin Med 1995; 71: 132-3.
Dore G, Cooper D, Barrett C et al. Dual efficacy of lamivudina treatment in HIV / Hepatitis B Virus – coinfected persons in a randomized, controlled study (CAESAR). J Infect Dis 1999; 180: 607-13.
Fang J, Wright T, Lau J. Fibrosing cholestatic hepatitis in patient with HIV and hepatitis B. Lancet 1993; 342: 1175.
García-Samaniego J, Soriano V, Castilla J et al. Influence of hepatitis C genotypes and HIV infection on histological severity of chronic hepatitis C. Am J Gastroenterol 1997; 92: 1130-4.
Gilson R, Hawkins A, Beecham M et al. Interactions between HIV and hepatitis B virus in homosexual men: effects on the natural history of infection. AIDS 1997; 11: 597-606.
Krogsgaard K, Lindhardt B, Nielsen J et al. The influence of HTLV III infection on the natural history of hepatitis B virus infection in male homosexual HBsAg carriers. Hepatology 1987; 7: 37-41.
Sánchez-Quijano A, Andreu A, Gavilán F et al. Influence of HIV-1 on the natural course of chronic parenterally acquired hepatitis C. Eur J Clin Microb Infect Dis 1995; 14: 949-53.
Soriano V, García-Samaniego J, Rodríguez-Rosado R et al. Impact of chronic viral liver disease due to hepatitis viruses as cause of hospital admission and death in HIV-infected drug users. Eur J Epidemiol 1999; 15: 1-4.
Soriano V, Kirk O, Antunes F et al. The influence of hepatitis C on the prognosis of HIV: The EuroSida Study. XIII Int AIDS Conf, Durban, July 2000 [Abstract ThOrB655].
Soriano V, Rodríguez-Rosado R, García-Samaniego J. Management of chronic hepatitis C in HIV-infected patients. AIDS 1999; 13: 539-46.
Thomas D, Astembrorki J, Rai R et al. The natural history of hepatitis C virus infection. JAMA 2000; 284: 450-6.
Artículo y más información: TodoSida